Měď
Měď (chemická značka Cu, latinsky Cuprum) je ušlechtilý kovový prvek načervenalé barvy, používaný člověkem již od pravěku: v pozdní době kamenné, zvané eneolit (též chalkolit, doba měděná) se začala měď těžit, tavit a zpracovávat vedle dosavadních kamenných industrií a předznamenala tak nástup doby bronzové. Do této doby (cca 3200 př. n. l.) patří např. nález těla tzv. Ötziho, vybaveného měděnou sekyrou remedellské kultury, r. 1990 v Alpách na hranici Rakouska a Itálie.[2] Nejstarší doklady o tavení tohoto kovu v primitivních pecích, v nichž se topilo datlovými peckami nebo suchým trusem, pocházejí z 3. tisíciletí ze severní Mezopotámie.[3] V období Římské říše se měď těžila hlavně na Kypru, proto dostala jméno cyprium (kov Kypru); později se zkrátilo na cuprum. České slovo měď (a podobně v ostatních slovanských jazycích) pochází se staré perštiny, která tento kov nazývala med,[4] nebo také možná původně z názvu Médie, oblasti v Turecku a severozápadním Íránu, přes kterou se měď na Iónské ostrovy a dál do Evropy dovážela.[5] Území Persie (přibližně dnešní Írán a Afghánistán) patřilo k nejstarším nalezištím měděné rudy. Měď se vyznačuje velmi dobrou tepelnou a elektrickou vodivostí, dobře se mechanicky zpracovává a je odolná k atmosférické korozi. Je základní součástí řady velmi důležitých slitin a mimořádně důležitá pro elektrotechniku.
Historický význam
Většina etap lidských dějin nese názvy po kovech či jejich slitinách a měď zde stojí na samém počátku. Lidé v době kamenné se naučili mechanickou úpravou za studena zpracovávat kov, nalezený v nativní podobě. Jednalo se o zlato, stříbro a měď. Tyto výrobky sloužily většinou ke zdobení a neměly výrazný vliv na technický rozvoj. Aby bylo možné z kovu vyrábět nástroje, bylo nutné ho získat v množství, které nálezy čistého kovu neumožňovaly. Že lze kov získat zahřátím určitých kamenů v redukčním prostředí, nemohlo napadnout ani toho nejtalentovanějšího jedince v době kamenné. Teplo a v některých částech i redukční prostření však poskytovalo ohniště, šlo jen o to dostat do pravých míst pravý kámen. K potřebné náhodě došlo nezávisle na celém světě zhruba ve stejné době kolem 5. tisíciletí před naším letopočtem. Kameny, atraktivní svým vzhledem, obsahující malachit a azurit se staly předmětem šamanských manévrů na jejichž výstupech se ocitly kapičky mědi spojené struskou v kujnou hmotu.[6] Uhlík a oxid uhelnatý se za vysoké teploty setkal s uhličitany mědi. Mezi lidská poznání přibyl první metalurgický proces. Následovalo hledání a dobývání měděné rudy a zdokonalovaní výrobního procesu. Nejcennější stopu po způsobu dobývání rudy poskytuje prehistorický důl Rudna Glava v Srbsku,[7] spojený s kulturou Vinča. Hutní proces nejlépe prokazuje archeologické naleziště Los Millares ve Španělsku. Na západní polokouli ve stejné době došlo k rozvoji metalurgie mědi v Peru během aktivit kultury Moche.
V procesu, objeveném díky mědi, se časem ocitly i rudy jiných kovů, redukcí za tepla byl získán cín a začala tak doba bronzová. Později do žáru dřevného uhlí zamířil magnetovec. Po vykování prvního předmětu z železné houby nastala doba železná, která trvá dodnes. Čistá měď ustoupila do pozadí až do konce 19. století, kdy se navíjený měděný drát stal nezbytným prvkem éry elektřiny. S pravděpodobností blížící se jistotě stály na počátku technického pokroku vzhledově atraktivní uhličitany mědi.
Základní fyzikálně-chemické vlastnosti
Typický kovový prvek, kovově lesklý s červeným nádechem. Na vzduchu vlivem oxidace tmavne a pozvolna přechází do rezavohnědé barvy. Ve velmi tenkých plíšcích prosvítá zelenomodře. Krystalizuje v kubické plošně centrované soustavě. Patří mezi přechodné prvky, které mají valenční elektrony v d-sféře a patří do I.B skupiny. Měď, stejně jako stříbro a zlato, které se nacházejí ve stejné skupině, se většinou vlastností podobají svým sousedům nalevo v periodické tabulce (prvkům VIII.B skupiny a tedy přechodným kovům – nikl, palladium a platina), v některých vlastnostech se však velmi podobají prvkům I.A skupiny – alkalickým kovům, tedy prvkům nepřechodným. Společný rys se sousedy vlevo má měď v oxidačním stupni Cu2+ a svých barevných komplexech a společný rys s alkalickými kovy má zejména Cu1+. V těchto dvou oxidačních stupních tvoří měď nejvíce sloučenin, vzácně i v oxidačním stupni Cu3+ a Cu4+. Trojmocnou měď je nutné stabilizovat velkými anionty.
K rozpouštění mědi v minerálních kyselinách dochází, jako ušlechtilý kov však nedokáže z kyseliny vytěsnit kation vodíku, a proto se rozpouští v oxidujících kyselinách nebo v neoxidujících kyselinách v prostředí oxidačních činidel.
Ve zředěném roztoku kyseliny chlorovodíkové se měď nerozpouští. Pokud se do roztoku přidá oxidační činidlo (nejběžněji peroxid vodíku), probíhá rozpouštění velmi pomalu až bouřlivě v závislosti na koncentraci kyseliny a peroxidu. V koncentrované kyselině chlorovodíkové se měď také nerozpouští, v přítomnosti oxidačních činidel však probíhá rozpouštění poměrně rychle za vzniku zeleného roztoku chloridu měďnatého.
- 2 HCl + H2O2 + Cu → CuCl2 + 2 H2O
Ve zředěném roztoku kyseliny sírové se měď nerozpouští, v přítomnosti oxidačního činidla se však rozpouští za vzniku zelenomodrého roztoku síranu měďnatého. V koncentrované kyselině sírové, která je sama oxidující kyselinou, se měď zprvu nerozpouští a pouze černá na oxid měďnatý, přičemž se uvolňuje se oxid siřičitý, a teprve po zčernání mědi se oxid měďnatý rozpouští v kyselině sírové na modrý roztok síranu měďnatého.
- H2SO4 + H2O2 + Cu → CuSO4 + 2 H2O
- Cu + H2SO4 → CuO + SO2 + H2O
- CuO + H2SO4 → CuSO4 + H2O
Ve zředěném roztoku kyseliny dusičné, která je oxidující kyselinou, se měď rozpouští za vzniku modrého roztoku dusičnanu měďnatého a uvolňování oxidu dusnatého. V koncentrované kyselině dusičné, která je také oxidující kyselinou, se měď rozpouští za vzniku modrého roztoku dusičnanu měďnatého a uvolňování oxidu dusičitého.
- 3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
- Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2 + 2 H2O
V alkalických hydroxidech je měď nerozpustná, dobře se však rozpouští v koncentrovaných roztocích alkalických kyanidů za vývoje vodíku.
- 2 Cu + 2 H2O + 4 CN− → 2 [CuI(CN)2] + 2 OH− + H2
Ke korozi na vzduchu vykazuje měď (velmi) dobrou odolnost, neboť se působením kyslíku, atmosférické vlhkosti a oxidu uhličitého pokrývá tenkou vrstvičkou zeleného zásaditého uhličitanu měďnatého (CuCO3 . Cu(OH)2) – měděnkou, která ji účinně chrání proti další korozi (tzv. pasivace). Proto se silnější vrstva měděnky vytvoří, v závislosti na vzdušné vlhkosti, za několik měsíců až mnoho let. Na měď působí za pokojové teploty a vzdušné vlhkosti i chlór. Za vyšší teploty se měď slučuje s velkým počtem prvků; k nejvýraznějším vlastnostem patří slučivost se sírou. Sloučeniny měďnaté barví plamen zeleně.
Měď vede v čistém stavu velmi dobře elektrický proud, po stříbře vykazuje druhou nejlepší vodivost ze všech kovových prvků za normální teploty.Vodivost se však výrazně snižuje i při velmi malém obsahu nečistot, zejména antimonu a arzénu. Zároveň je i výborným vodičem tepla. (Z praxe: Je třeba elektrodou k sobě svařit dva vodorovné ocelové plechy tloušťky 6 mm, mezera také 6 mm. Zespod se přitiskne měděná destička tloušťky 10 mm. Poté se začnou el. obloukem tyto plechy k sobě svářet. Ačkoliv teplota oblouku je 3000 °C a roztavené oceli 1500 °C, měď odvádí teplo tak rychle, že se ani nenataví a žhavou lázeň udrží. Destička—neporušená—pak odpadne). Čistá kovová měď je poměrně měkká, a proto se pro praktické aplikace často používají její slitiny. Měď je velmi tažná a kujná a i proto se z ní vyrábějí vodiče elektrického proudu.
U určitého druhu mědi se při teplotě vyšší než 400 °C vyskytuje tzv. vodíková nemoc. Jde o měď obsahující O2 nad 0,003% (u bezkyslíkové mědi nad 0,002%). Za vysokých teplot do mědi difunduje (proniká) vodík, který se následně váže s kyslíkem v mědi a vytváří molekuly vody v podobě vodní páry. Vodní pára působí tlakem na okolní strukturu materiálu a vznikají malé trhlinky, jejichž následkem je zhoršení mechanických vlastností mědi.
Jestliže měď rozžhavíme a namočíme ve vodě, změkne. Časem opět sama ztvrdne. Této vlastnosti využívali například mědikovci. Automechanici si takové nýty dávali do ledničky, aby déle vydržely měkké.
Výskyt
Měď je v zemské kůře přítomna poměrně vzácně. Odhaduje se, že její obsah činí 55 – 70 ppm (mg/kg). V mořské vodě se její koncentrace pohybuje pouze na úrovni 0,003 miligramů v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom mědi přibližně 1 miliarda atomů vodíku.
Ryzí měď se v přírodě nachází, avšak pouze vzácně ve větším množství a vyskytuje se tedy převážně ve sloučeninách. Elementární měď se hojněji vyskytuje u Hořejšího jezera v Severní Americe. Nejčastěji se nachází ve formě sulfidů, k nimž patří například chalkocit neboli leštěnec měděný Cu2S, covellin CuS, bornit Cu3FeS3, bournonit (Cu2. Pb)3[SbS3]2 a chalkopyrit neboli kyz měděný CuFeS2. Dalšími významnými minerály jsou kuprit Cu2O, zelený malachit CuCO3 . Cu(OH)2 a jemu chemicky podobný modrý azurit 2 CuCO3 . Cu(OH)2.
K největším světovým producentům mědi patří především Chile, Peru a USA v Novém Mexiku a Utahu. Významná ložiska měděných rud se nacházejí také v Zairu, Zambii, Kanadě, Kazachstánu a Polsku.
Měď patří také k biogenním prvkům, neboť je součástí hemocyaninu, obsaženého v krvi měkkýšů.
Výroba[editovat | editovat zdroj]
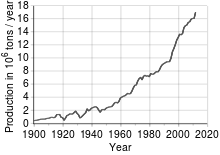
Hlavním zdrojem pro průmyslovou výrobu mědi jsou sulfidické rudy, které jsou poměrně bohaté na železo; obsah mědi se v nich pohybuje kolem 1 %. Vytěžená ruda se proto nejprve drtí a koncentruje, čímž obsah mědi stoupne na 15 až 20 %.
Výroba mědi ze sulfidických rud probíhá ve třech základních krocích. Třetí krok se však postupem času změnil a dnes se již nevyužívá ani německého pochodu pražně-redukčního, ani anglického pochodu pražně-reakčního.
1. Pražení je první základní krok, jehož podstatou je odstranění co možná největšího podílu síry z rudy a převedení co možná největšího podílu sulfidů na oxidy. Oxidy arzénu a antimonu při pražení vytěkají. Když klesne obsah síry v rudě natolik, že na jeden atom mědi připadá přibližně jeden atom síry, následuje druhý krok.
- Cu2S + 2 O2 → 2 CuO + SO2
2. Tavení na měděný lech (kamínek) probíhá v šachtových nebo plamenných pecích za přidání koksu a struskotvorných přísad (nejčastěji oxid křemičitý) při teplotě 1400 °C, aby se odstranil sulfid železnatý FeS. Při tomto pochodu přechází oxid měďnatý, vzniklý v minulém kroku, opět v sulfid a sulfid železnatý reaguje s oxidem křemičitým na křemičitan železnatý, který tvoří strusku. Sulfid měďný, který při reakci vzniká, se spolu s dalšími sloučeninami usazuje na dně taveniny jako měděný lech neboli kamínek. Po odstranění velkého podílu sulfidu železnatého z rudy následuje třetí krok.
- 2 CuO + FeS + C + SiO2 → Cu2S + FeSiO3 + CO
3. Zpracování měděného lechu na surovou měď se dnes výhradně provádí dmýcháním v konvertoru; tato metoda je označována jako pražení s dmýcháním nebo besemerace mědi (jejím vynálezcem byl Henry Bessemer). Tento způsob výroby spočívá v kombinaci pochodu pražně-redukčního a pochodu pražně-reakčního. Roztavený měděný lech se vlije do konvertoru se zásaditou nebo kyselou vyzdívkou podle toho, zda ruda obsahuje zásadité nebo kyselé přísady, a vhání se stlačený vzduch. Zbytky sulfidu železnatého přecházejí na oxid a vytvářejí tak strusku. Poté probíhá oxidace sulfidu měďného na oxid měďnatý, který se energicky redukuje se sulfidem měďným na kovovou měď.
- 2 Cu2O + Cu2S → 6 Cu + SO2
Oxidické měděné rudy lze zpracovávat na kov přímou redukcí koksem za vysoké teploty, častěji se však přidávají k sulfidickým rudám mědi, kde tyto rudy působí oxidačně a urychlují tak redukci sulfidu na oxid, popřípadě na kov při vhodně zvoleném poměru.
- 2 Cu2O + Cu2S → 6 Cu + SO2
Surová měď, tzv. černá měď, se čistí elektrolyticky. Anodou je surová měď, jako elektrolyt se používá kyselý roztok síranu měďnatého CuSO4 a katodu tvoří čistá měď. Nečistoty, které se hromadí v okolí anody jako anodické kaly, jsou cenným zdrojem stříbra, zlata a dalších těžkých kovů.
Použití
Měď se nevyužívá jen v čisté podobě, ale ze 45% také ve slitinách, např. bronzu nebo mosazi.
Čistý kov
1. Čistá měď nalézá uplatnění pro svoji odolnost vůči korozi, protože se na vzduchu působením atmosférické vlhkosti a oxidu uhličitého rychle pokryje tenkou souvislou vrstvičkou nazelenalého zásaditého uhličitanu měďnatého (CuCO3 . Cu(OH)2) (měděnka) který ji účinně chrání proti další korozi. Vzhledem k dnešnímu znečištěnému ovzduší však chemická reakce zabarví měď do hněda. Pokud bychom chtěli historickou zelenou patinu, musí se měď ještě potřít zvláštní směsí, jejíž složkou je čpavek.
Měď se používá např. pro:
- střešní krytiny – vzhledem k vysokým nákladům především pro pokrývání střech chrámů, věží, historických staveb a podobně;
- materiál pro odolné okapy a střešní doplňky;
- trubice pro rozvody technických plynů (s výjimkou acetylenu, který tvoří s mědí acetylid a materiál pak rychle koroduje);
- ražbu mincí.
2. Vysoká elektrická vodivost se uplatňuje při výrobě:
- elektrických vodičů jak pro průmyslové aplikace (elektromotory, elektrické generátory apod.), tak i pro rozvody elektrické energie v bytech apod.;
- elektronických součástek, např. integrovaných obvodů.
3. Vynikající tepelná vodivost mědi se uplatní při výrobě:
- kotlů a zařízení pro rychlý a bezeztrátový přenos tepla;
- chladičů, např. v počítačích, automobilech a průmyslových zařízeních;
- kuchyňského nádobí;
- klempířství – chceme-li měď pájet (nebo také letovat) cínem, musíme budoucí spoj připravit potřením kyselinou chlorovodíkovou, převařenou se zinkem; do otevřené nádobky nalijeme kyselinu a vkládáme do ní zinek tak dlouho, až přestane reagovat; získáme tak chlorid zinečnatý (nemáme-li zinek, lze v nouzi použít i kousky pozinkovaného plechu, trvá to však dlouho);
- z historie: nahrazování mědi hliníkem v elektrotechnice zavedli Němci za 2. svět. války, když neměli přístup k mědi; Pracovní vlaky jezdily od nádraží k nádraží a všude sbíraly měděné dráty a vyměňovaly je za hliníkové; po válce v Československu byly v prodeji dráty hliníkové i měděné, měděné však byly mnohem dražší, proto lidé i podniky používali nadále dráty hliníkové (měď musel komunistický režim kupovat za převoditelné měny).
Bronz
Patrně nejvýznamnější slitinou mědi je bronz. O jeho významu hovoří již skutečnost, že dal jméno dlouhému období prehistorie a rané historie lidstva (doba bronzová), sportovci za třetí umístění dostávají bronzové medaile atd.
Nejznámějším bronzem je slitina mědi s cínem. Pod pojmem bronz však rozumíme slitinu mědi s jakýmkoliv prvkem mimo zinek (taková slitina se nazývá mosaz).
Přídavek cínu do kovové mědi odstraňuje její hlavní nedostatek pro výrobu prakticky použitelných nástrojů – malou tvrdost. Přitom zůstává zachována vysoká odolnost proti korozi a relativně snadná opracovatelnost. V době bronzové sloužil tento kov jak pro výrobu zbraní, tak pro zhotovování celé řady nástrojů pro řemeslnou výrobu a domácnost i dekorativních předmětů. Existuje dokonce teorie, že k přechodu na daleko obtížněji vyrobitelné železo nedošlo pro lepší vlastnosti železa, ale kvůli vyčerpání snadno těžitelných cínových rud. Z cínového bronzu se vyrábějí součásti spínačů, sběrné kroužky, kontaktní segmenty apod.
I v současné době má bronz mimořádný význam. Existují stovky slitin tohoto typu, z nichž mnohé obsahují kromě mědi a cínu řadu dalších kovů, např. niklu (dělovina, odporové vodiče, termoelektrické články), manganu, olovoa, beryllia, hliníku (součástky odolné vyšším teplotám) i nekovů (fosfor, křemík).
Praktické využití bronzu je spojeno především s jejich vysokou odolností proti korozi, přestože jeho cena je výrazně vyšší než cena železa nebo oceli. Z bronzu se vyrábějí kovové součástky čerpadel, která pracují s vysokými tlaky v agresivním prostředí, kluzná ložiska, pružinová péra a velmi často součásti lodí a ponorek, protože velmi dobře odolávají působení mořské vody. Stejně jako v minulosti je pak bronz materiálem pro zhotovení soch, pamětních desek a mincí, medailí a podobných předmětů.
Mosaz
Slitina mědi se zinkem se nazývá mosaz. Mosaz obsahuje optimálně 32% zinku (maximálně 42%). Existují stovky různých mosazí, jejichž přesné složení je dáno mezinárodními normami a liší se od sebe mechanickými vlastnostmi (tvrdost, pevnost, mechanická opracovatelnost atd.), bodem tání a zpracovatelností litím (možností odlévání).
Běžná mosaz je poměrně měkká slitina jasně zlatavé barvy s poměrně nízkou chemickou odolností vůči kyselinám a louhům. Proti působení atmosférických vlivů je však mosaz značně odolná.
Používá se často k výrobě hudebních nástrojů a dekorativních předmětů, zhotovují se z ní součásti pro vybavení koupelen a drobné bytové doplňky a slouží také k výrobě bižuterie jako tzv. kočičí zlato. Díky vizuální podobnosti se zlatem se mohou vyskytnout i pokusy o úmyslnou záměnu a oklamání důvěřivého zákazníka. Poměrně časté jsou případy, kdy většina předmětu (např. ozdobný masivní řetízek) je vyrobena z mosazi a pouze na povrchu pozlacena. Při testu na kameni (buližník) nebo metodou rentgenové fluorescence se pak předmět jeví jako skutečně zlatý, protože se v obou případech zkouší pouze povrch.
V současné době existují i způsoby elektrolytického vylučování mosazných vrstev na kovový podklad a tohoto elektrolytického pomosazení se využívá k povrchové protikorozní ochraně především železných předmětů.
Klenotnické, dentální a mincovní slitiny
Zlaté klenotnické slitiny obsahuji kromě zlata nejčastěji stříbro a měď, můžeme v nich však nalézt i zinek, nikl, palladium a další kovy. Hlavním důvodem pro výrobu zlatých šperků ze slitin je velmi malá mechanická odolnost čistého zlata (měkkost, snadný otěr). Přídavky doprovodných kovů zvyšují tvrdost slitiny a mohou mít i estetický efekt. Měď se ve zlatých klenotnických materiálech vyskytuje v rozmezí 0 – 30 % a podle jejího obsahu je možno docílit i zvoleného barevného odstínu slitiny od zářivě žluté až po téměř červenou.
Stříbrné šperky jsou obvykle vyráběny ze slitin stříbra s mědí, v nichž obsah mědi činí 3 – 10 %. Důvodem je opět větší mechanická odolnost slitiny oproti čistému stříbru a navíc větší odolnost vůči korozi atmosférickými plyny s obsahem síry (oxid siřičitý, sulfan…).
Dentální slitiny, používané pro výrobu zubních náhrad, musí být především zdravotně nezávadné, tedy odolné proti korozi materiálu v chemicky poměrně silně agresivním prostředí ústní dutiny. K jejich výrobě se proto používají především drahé kovy jako zlato, stříbro, palladium, platina nebo iridium a další kovy jako měď, zinek, cín, antimon nebo indium mají za účel upravit mechanické vlastnosti slitiny, např. tvrdost a opracovatelnost.
Jiným typem dentální slitiny, používané pro zubní výplně, jsou dentální amalgámy. Tyto materiály obvykle tvoří slitina stříbra, mědi a cínu, která je velmi jemně rozmělněna. Před vlastním úkonem v zubní ordinaci se k definovanému množství této směsi přidá elementární rtuť, která během několika minut vytvoří velmi pevnou a chemicky odolnou slitinu – amalgám. Proto je velmi důležité, aby zubní lékař vyplnil dutiny v zubu amalgámem v relativně krátké době po smíchání, kdy je směs ještě tvárná.
Pro mincovní kovy se slitiny mědi s niklem a zinkem používají k ražbě mincí s vyšší nominální hodnotou právě pro poměrně vysokou cenu čisté mědi. Přísady mědi zde mají účel upravit zbarvení slitiny do žluta až červena a zároveň zvyšují korozní odolnost mince.
Sloučeniny
Ve sloučeninách se měď vyskytuje především v mocenstvích Cu1+ a Cu2+, vzácně i Cu3+ a ve velmi nestabilních sloučeninách Cu4+. Nejstálejší jsou sloučeniny Cu2+, které mají obvykle modrou nebo zelenou barvu. Sloučeniny Cu1+ svým chemickým chováním připomínají soli stříbrné, zatímco sloučeniny Cu3+ jsou mimořádně nestálé a za běžných podmínek se samovolně rozkládají.
Anorganické sloučeniny
Sloučeniny měďné Cu1+
Jsou látky často špatně rozpustné nebo úplně nerozpustné ve vodě. Soli jsou nejčastěji v bezvodém stavu bílé a v hydratovaném barevné; některé tvoří komplexní sloučeniny, které jsou nejčastěji bezbarvé.
Oxid měďný Cu2O je červená až černohnědá jemně práškovitá látka, nerozpustná ve vodě. Ve vodě se však rozpouští v prostředí amoniaku a koncentrovaného roztoku halogenovodíkové kyseliny za vzniku komplexních sloučenin. V přírodě se vyskytuje jako nerost kuprit. Působením zředěných kyslíkatých kyselin dojde k autooxidaci oxidu měďného za vzniku měďnaté soli a mědi. Oxid měďný se uplatňuje při barvení ve sklářství a keramice na červeno, do barev k nátěru dna lodí a slouží také k hubení škůdců. Oxid měďný se připravuje přidáním hydroxidu sodného a hroznového cukru k roztoku měďnaté soli nebo Fehlingovu roztoku.
Chlorid měďný CuCl je v čerstvém stavu bílý prášek nerozpustný ve vodě, který na vlhkém vzduchu nabíhá rychle do zelena. Chlorid měďný vytváří komplexní, adiční i podvojné sloučeniny. Připravuje se zahříváním měděných hoblin v koncentrované kyselině chlorovodíkové za přídavku malého množství chlorečnanu draselného. Může se také připravit redukcí chloridu měďnatého kyselinou siřičitou.
Bromid měďný CuBr je žlutozelená krystalická látka, nerozpustná ve vodě, která tvoří adiční a komplexní sloučeniny. Připravuje se tepelným rozkladem bromidu měďnatého.
Jodid měďný CuI je v čistém stavu bílý prášek, který se přimíšením jódu barví do hněda až černa; je nerozpustný ve vodě. V roztocích tvoří adiční a komplexní sloučeniny. Připravuje se zahříváním mědi s jódem a horkou koncentrovanou kyselinou jodovodíkovou nebo smíšením alkalického jodidu s roztokem měďnaté soli a přídavkem oxidu siřičitého nebo thiosíranu sodného.
Kyanid měďný CuCN je bílý prášek, nerozpustný ve vodě a zředěných kyselinách. Rozpouští se v koncentrovaných kyselinách, amoniaku a roztocích amonných solí za vzniku komplexních sloučenin. Připravuje se reakcí kyanidových iontů s měďnatými kationty, přičemž se zprvu vzniklý kyanid měďnatý rozkládá na dikyan a kyanid měďný.
Rhodanid měďný CuSCN je bílý prášek, ve vodě a kyselinách za chladu nerozpustný. V nadbytku rhodanidu se rozpouští za vzniku komplexní sloučeniny. Rhodanid měďný dokáže adovat amoniak, který se však opět snadno odštěpuje. Rhodanid měďný se připravuje reakcí měďnaté soli s rhodanidovými anionty za přítomnosti redukčního činidla.
Siřičitan měďný Cu2SO3